Las plantas dependen de un proceso llamado fijación de carbono, que convierte el dióxido de carbono del aire en biomoléculas ricas en carbono, para su propia existencia.
por Glennda Chui, Laboratorio Nacional de Aceleradores de SLAC
Ese es el punto central de la fotosíntesis, y una piedra angular del vasto sistema entrelazado que recicla el carbono a través de plantas, animales, microbios y la atmósfera para sustentar la vida en la Tierra.
Pero los campeones de la fijación de carbono no son las plantas, sino las bacterias del suelo. Algunas enzimas bacterianas llevan a cabo un paso clave en la fijación de carbono 20 veces más rápido que las enzimas vegetales, y descubrir cómo lo hacen podría ayudar a los científicos a desarrollar formas de fotosíntesis artificial para convertir los gases de efecto invernadero en combustibles, fertilizantes, antibióticos y otros productos.
Ahora, un equipo de investigadores del Laboratorio Nacional del Acelerador SLAC del Departamento de Energía, la Universidad de Stanford, el Instituto Max Planck de Microbiología Terrestre en Alemania, el Instituto Conjunto del Genoma (JGI) del DOE y la Universidad de Concepción en Chile ha descubierto cómo una enzima bacteriana, una molécula máquina que facilita las reacciones químicas: se acelera para realizar esta hazaña.
Descubrieron que, en lugar de agarrar moléculas de dióxido de carbono y unirlas a biomoléculas una a la vez, esta enzima consta de pares de moléculas que funcionan sincronizadas, como las manos de un malabarista que lanza y atrapa pelotas simultáneamente, para hacer el trabajo más rápido. . Un miembro de cada par de enzimas se abre de par en par para atrapar un conjunto de ingredientes de reacción, mientras que el otro se cierra sobre sus ingredientes capturados y lleva a cabo la reacción de fijación de carbono; luego, intercambian roles en un ciclo continuo.
Un solo punto de “pegamento” molecular mantiene juntas cada par de manos enzimáticas para que puedan alternar la apertura y el cierre de manera coordinada, descubrió el equipo, mientras que un movimiento giratorio ayuda a empujar los ingredientes y los productos terminados dentro y fuera de los bolsillos donde se producen las reacciones. tener lugar. Cuando están presentes tanto el pegamento como la torsión, la reacción de fijación del carbono es 100 veces más rápida que sin ellos.
“Esta enzima bacteriana es el fijador de carbono más eficiente que conocemos, y se nos ocurrió una clara explicación de lo que puede hacer”, dijo Soichi Wakatsuki, profesor de SLAC y Stanford y uno de los principales líderes del estudio. que se publicó en ACS Central Science esta semana.
“Algunas de las enzimas de esta familia actúan lentamente pero de una manera muy específica para producir un solo producto”, dijo. “Otros son mucho más rápidos y pueden crear bloques de construcción químicos para todo tipo de productos. Ahora que conocemos el mecanismo, podemos diseñar enzimas que combinen las mejores características de ambos enfoques y hagan un trabajo muy rápido con todo tipo de materiales de partida”.
Mejorando la naturaleza
La enzima que estudió el equipo es parte de una familia llamada enoil-CoA carboxilasas/reductasas o ECR. Proviene de una bacteria del suelo llamada Kitasatospora setae, que además de sus habilidades para fijar carbono también puede producir antibióticos.
Wakatsuki se enteró de esta familia de enzimas hace media docena de años por Tobias Erb del Instituto Max Planck de Microbiología Terrestre en Alemania y Yasuo Yoshikuni de JGI. El equipo de investigación de Erb había estado trabajando para desarrollar biorreactores para la fotosíntesis artificial para convertir el dióxido de carbono (CO 2 ) de la atmósfera en todo tipo de productos.
Tan importante como es la fotosíntesis para la vida en la Tierra, dijo Erb, no es muy eficiente. Como todas las cosas moldeadas por la evolución a lo largo de los eones, es tan bueno como debe ser, el resultado de construir lentamente sobre desarrollos anteriores pero nunca inventar algo completamente nuevo desde cero.
Además, dijo, el paso en la fotosíntesis natural que fija el CO 2 del aire, que depende de una enzima llamada Rubisco, es un cuello de botella que atasca toda la cadena de reacciones fotosintéticas. Por lo tanto, el uso de enzimas ECR rápidas para llevar a cabo este paso, y diseñarlas para que vayan aún más rápido, podría generar un gran impulso en la eficiencia.
“No estamos tratando de hacer una copia al carbón de la fotosíntesis”, explicó Erb. “Queremos diseñar un proceso que sea mucho más eficiente utilizando nuestra comprensión de la ingeniería para reconstruir los conceptos de la naturaleza. Esta ‘fotosíntesis 2.0’ podría tener lugar en sistemas vivos o sintéticos como los cloroplastos artificiales: gotas de agua suspendidas en aceite”.
Retratos de una enzima
Wakatsuki y su grupo habían estado investigando un sistema relacionado, la fijación de nitrógeno, que convierte el gas nitrógeno de la atmósfera en compuestos que necesitan los seres vivos. Intrigado por la pregunta de por qué las enzimas ECR eran tan rápidas, comenzó a colaborar con el grupo de Erb para encontrar respuestas.
Hasan DeMirci, un investigador asociado en el grupo de Wakatsuki que ahora es profesor asistente en la Universidad de Koc e investigador del Instituto Stanford PULSE, dirigió el esfuerzo en SLAC con la ayuda de media docena de pasantes de verano de SLAC que supervisó. “Entrenamos a seis o siete de ellos cada año, y no tenían miedo”, dijo. “Llegaron con la mente abierta, listos para aprender e hicieron cosas asombrosas”.
El equipo de SLAC tomó muestras de la enzima ECR y las cristalizó para examinarlas con rayos X en la Fuente Avanzada de Fotones en el Laboratorio Nacional Argonne del DOE. Los rayos X revelaron la estructura molecular de la enzima, la disposición de su andamiaje atómico, tanto por sí sola como cuando se une a una pequeña molécula auxiliar que facilita su trabajo.
Otros estudios de rayos X en la fuente de luz de radiación de sincrotrón de Stanford (SSRL) de SLAC mostraron cómo la estructura de la enzima cambiaba cuando se unía a un sustrato, una especie de banco de trabajo molecular que ensambla los ingredientes para la reacción de fijación de carbono y estimula la reacción.
Finalmente, un equipo de investigadores de Linac Coherent Light Source (LCLS) de SLAC llevó a cabo estudios más detallados de la enzima y su sustrato en el láser de electrones libres de rayos X SACLA de Japón. La elección de un láser de rayos X fue importante porque les permitió estudiar el comportamiento de la enzima a temperatura ambiente, más cerca de su entorno natural, casi sin daño por radiación.
Mientras tanto, el grupo de Erb en Alemania y el grupo del profesor asociado Esteban Vöhringer-Martinez en la Universidad de Concepción en Chile llevaron a cabo estudios bioquímicos detallados y extensas simulaciones dinámicas para dar sentido a los datos estructurales recopilados por Wakatsuki y su equipo.
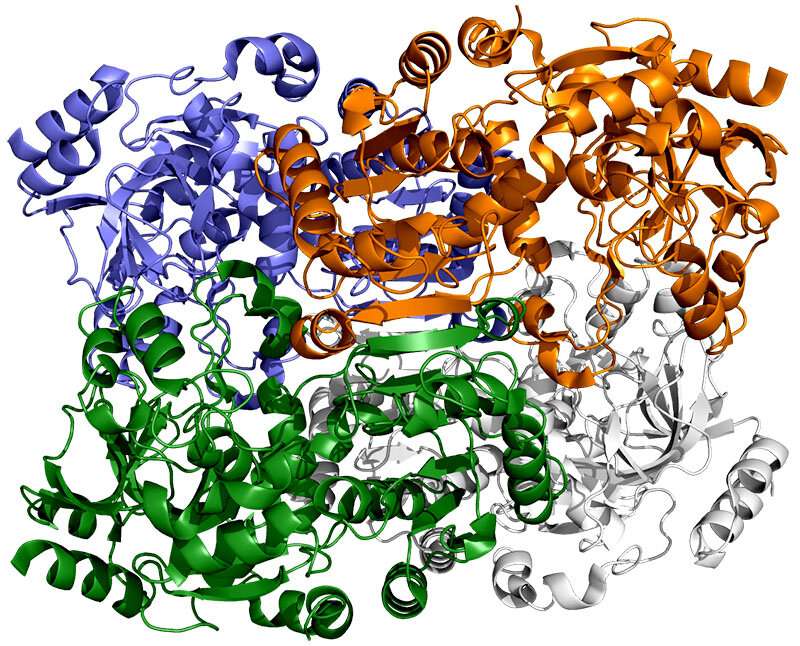
Las simulaciones revelaron que la apertura y el cierre de las dos partes de la enzima no solo involucran el pegamento molecular, sino también movimientos giratorios alrededor del eje central de cada par de enzimas, dijo Wakatsuki.
“Este giro es casi como un trinquete que puede empujar un producto terminado o tirar de un nuevo conjunto de ingredientes en el bolsillo donde tiene lugar la reacción”, dijo. Juntos, el giro y la sincronización de los pares de enzimas les permiten fijar carbono 100 veces por segundo.
La familia de enzimas ECR también incluye una rama más versátil que puede interactuar con muchos tipos diferentes de biomoléculas para producir una variedad de productos. Pero como no están unidos por pegamento molecular, no pueden coordinar sus movimientos y, por lo tanto, funcionan mucho más lentamente.
“Si podemos aumentar la velocidad de esas reacciones sofisticadas para crear nuevas biomoléculas”, dijo Wakatsuki, “sería un salto significativo en el campo”.
De tomas estáticas a películas fluidas
Hasta ahora, los experimentos han producido instantáneas estáticas de la enzima, los ingredientes de la reacción y los productos finales en varias configuraciones.
“Nuestro experimento soñado”, dijo Wakatsuki, “sería combinar todos los ingredientes a medida que fluyen en el camino del rayo láser de rayos X para que podamos ver la reacción en tiempo real”.
El equipo lo intentó en SACLA, dijo, pero no funcionó. “Las moléculas de CO 2 son realmente pequeñas y se mueven tan rápido que es difícil captar el momento en que se adhieren al sustrato”, dijo. “Además, el rayo láser de rayos X es tan fuerte que no pudimos mantener los ingredientes en él el tiempo suficiente para que se produjera la reacción. Cuando presionamos con fuerza para hacer esto, logramos romper los cristales”.
Una próxima actualización de alta energía a LCLS probablemente resolverá ese problema, agregó, con pulsos que llegan con mucha más frecuencia, un millón de veces por segundo, y se pueden ajustar individualmente a la fuerza ideal para cada muestra.
Wakatsuki dijo que su equipo continúa colaborando con el grupo de Erb, y está trabajando con el grupo de entrega de muestras de LCLS y con investigadores en las instalaciones de microscopía electrónica criogénica (crio-EM) de SLAC-Stanford para encontrar una manera de hacer que este enfoque funcione.
Más información: Hasan DeMirci et al, Intersubunit Coupling Enables Fast CO 2 -Fixation by Reductive Carboxylases, ACS Central Science (2022). DOI: 10.1021/accentsci.2c00057
